Biofunktionalisierung
Am Fraunhofer IMS werden Biosensoren aus Nanomaterialien beispielsweise auf Basis von Kohlenstoff entwickelt, mit denen sich unter anderem Viren und Bakterien nachweisen lassen. Damit dies selektiv passiert, sind Werkzeuge aus der Chemie nötig, um die Interaktion mit der Zielstruktur hoch spezifisch zu machen. Zur Biofunktionalisierung werden fluoreszente Nanomaterialien zunächst mit einer organischen Hülle (z. B. einem Biomakromolekül wie DNA) versehen. Diese wird anschließend chemisch so modifiziert, dass sie biologische Motive (z. B. Stoffwechselprodukte von Bakterien), Antikörper oder Signalmoleküle binden kann und sich dadurch die optischen Eigenschaften der fluoreszierenden Nanomaterialien ändern. Die Fähigkeit die funktionale Hülle (organische Phase) zu kontrollieren, die sich um die benutzten Nanomaterialien herum befindet, bildet also die Grundlage für eine selektive Biofunktionalisierung und damit für hochsensitive und schnelle Nanosensoren.
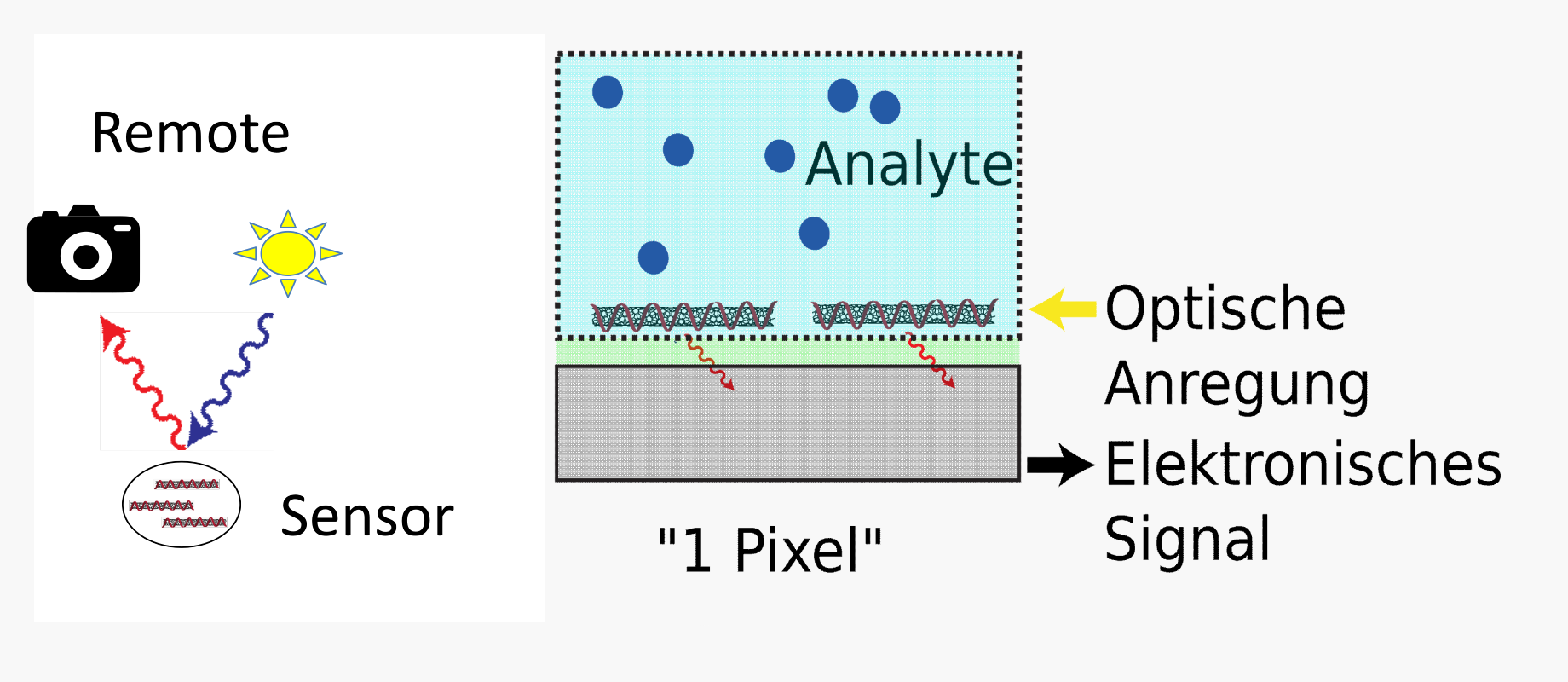
Bei der Entwicklung unserer Biosensoren kombinieren wir die Einzelmolekül-Sensitivität der biofunktionalisierten Nanomaterialien mit höchstsensitiven Einzelphotonen-Detektoren und erhöhen zugleich die Zahl der auswertbaren Sensoren. Hierfür kombinieren wir multiple optische Nanosensoren mit unterschiedlicher Biofunktionalisierung und integrieren sie in funktionalen Sensor-Arrays. So lassen sich Analyte anhand ihrer charakteristischen Signatur identifizieren und unterscheiden (»fingerprinting«). Auf diese Weise lassen sich z. B. Bakterien indirekt über ihre Stoffwechselprodukte nachweisen: unterschiedliche Bakterienarten geben charakteristische Mischungen aus Molekülen an ihre Umgebung ab, die zu ihrer Unterscheidung als »chemischer Fingerabdruck« genutzt werden können. Dies gelang beispielsweise mit Nanosensoren (https://www.nature.com/articles/s41467-020-19718-5), die auf Kohlenstoffnanoröhren basieren und chemisch so verändert wurden, dass sie sowohl verschiedene Stoffwechselprodukte von Bakterien als auch spezifische Virulenzfaktoren detektieren können. Anschließend wurden die verschieden biofunktionalisierten Nanosensoren in Hydrogel-Arrays immobilisiert. Durch Nah-Infrarot Bildgebung aus 25 cm Entfernung zu diesen Arrays konnten verschiedene Bakterienstämme nach Zugabe erfolgreich anhand ihres Intensitätsmusters unterschieden werden. Außerdem bietet die Einstellbarkeit der optischen Eigenschaften der Nanomaterialien durch ihre Größe weitere Möglichkeiten des Multiplexings und hat eine spektrale Kodierung zur Differenzierung der Bakterien ermöglicht. Die Technologie der biofunktionalisierten Nanosensoren bietet also das Potential als »künstliche Spürnase« eine ganze Bandbreite verschiedener Substanzen simultan zu erkennen und smarte Oberflächen zur differenzierten Pathogendiagnostik zu entwickeln.
Wir erforschen außerdem Methoden, mit denen man die sensitiven Nanomaterialien anwendungsorientiert auf unterschiedliche Oberflächenstrukturen aufbringen kann und deren Einfluss auf die Sensorik. Auch hier erweisen sich die verwendeten Nanomaterialien als vielseitig einsetzbar. Sie lassen sich, je nach Anwendung, z. B. auf glatten Oberflächen wie Silizium-basierten Substraten immobilisieren oder in porösen Matrizen aus polymerbasierten Hydrogelen einschließen. Unser Ziel ist die Entwicklung von »smarten Oberflächen«, die nicht nur in der Pathogendiagnostik von Vorteil sein können, sondern z. B. auch die Testung ganzer Wirkstoffbibliotheken für Medikamente ermöglichen oder die Suche nach neuen Impfstoffen revolutionieren könnten.